Van der Waals Kräfte ergeben sich aufgrund der elektrischen Dipolmomente und sind immer vorhanden, wenn Atome bzw. Moleküle aufeinander wirken. Anders als bei Adhä sionskräften oder den Haftkräften durch Flüssigkeitsbrücken, die nur dann wirken, wenn Wasser vorhanden ist, existieren Van der Waals Kräfte auch zwischen trockenen Parti keloberflächen, ebenso wie zwischen zwei Luftblasen in einer Flüssigkeit. Für die Berech nung der Van der Waals Wechselwirkungen von Körpern lassen sich zwei theoretische Ansätze unterscheiden. Die mikroskopische Berechnung (Hamaker) [97] geht vom Prinzip der Additivität der Wechselwirkungen von Atom bzw. Molekülpaaren aus, so dass die Van der Waals Kräfte zwischen den Körpern durch Integration über alle Paare von Atomen und Molekülen berechnet werden. Die makroskopische Berechnung (Lifshitz) [97] geht von den optischen Eigenschaften der wechselwirkenden Körper aus. Hierbei werden die Van-der-Waals-Kräfte aus dem imaginären Teil der komplexen frequenzabhängigen Dielektri-zitätskonstanten bestimmt [98]. Im Gegensatz zur mikroskopischen Berechnung nach Hamaker berücksichtigt die Lifshitz Theorie alle Arten der Van der Waals Kräfte: Keesom, Debye, und London Kraft. Sie berücksichtigt alle Bereiche des elektromagneti schen Spektrums, deren Wellenlänge groß ist im Vergleich zu den atomaren Abständen. Sie verliert ihre Gültigkeit, wenn die Dimensionen des makroskopischen Körpers nicht mehr groß gegenüber atomaren Abständen sind und wenn die beteiligten Medien nicht isotrop sind. Ein detaillierter Vergleich des theoretischen Hintergrundes beider Ansätze ist in [98] enthalten.
Aus physikalischer Sicht befriedigt die Theorie von Lifshitz mehr [88]. Dennoch wird gerade in neueren Veröffentlichungen zur Schüttgutmechanik überwiegend auf die An wendung der Theorie von Hamaker Bezug genommen [99]. Die geringe Reichweite der Van der Waals Wechselwirkungen hat zur Folge, dass beim Kontakt von Körpern die un mittelbare Geometrie der Kontaktstellen für die Intensität der Wechselwirkungen sehr maßgeblich ist. Damit gewinnen Kornform und Oberflächenrauhigkeiten entscheidenden Einfluss auf die Haftkräfte. Die Rolle der Van-der-Waals-Kräfte nimmt nach [100] bei Partikeldurchmessern > 100µm stark ab.
In Abhängigkeit der Adhäsionspartner (Kugel/Kugel, Kugel/Platte) gibt Schubert an ideal glatten, starren Modellkörpern für Abstände < 50 nm folgende Formeln für die Berech nung der Van der Waals Kräfte an:

AH = Hamaker-Konstante [J],[Nm] , siehe Erläuterung zu Formel 29
a = Abstand der Festkörper; bei Kontakt: a= 0,4 Nanometer [nm].
R1, R2 = Radius der Partikel 1 bzw. 2
Die Formeln gelten für Abstände a < 50 nm. Für größere Abstände sind die Vander Wals Kräfte wesentlich kleiner als sie sich nach diesen Formeln ergäben.Für den Ab standswert a wird im Kontaktfall der Festkörper ein Gleichgewichtsabstand von 0,4 nm eingesetzt, der auf Untersuchungen von Krupp [110] zurückgeht. Unterhalb dieses Abstandes wachsen die intermolekularen Repulsivkräfte stark an.
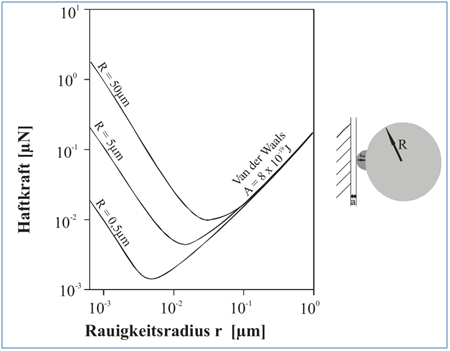
Nach Molerus [102] gilt für Partikel mit einem Durchmesser dp1,2> 1µm, dass deren Haftkraftverhalten durch die Oberflächenrauhigkeiten im Bereich von unter 0,1 µm festgelegt ist. Abbildung 66 stellt den Zusammenhang dar für den Kontaktfall Platte/rauhe Kugel für eine Hamaker Konstante von A = 8*10-19 J.
Zunächst nimmt die Haftkraft mit steigendem Radius r der Rauhigkeit stark ab, um mit weiter wachsendem r dann wieder anzusteigen. Bei kleinen Rauhigkeitserhebungen do miniert noch die auf die Grundkugel wirkende Adhäsionskraft, deren Abstand sich jedoch mit wachsendem r immer weiter vergrößert und die Adhäsionskraft dadurch verringert. Bei weiterer Zunahme von r wird dann die Van der Waals Kraft der Rauhigkeitserhebung für die gesamte Adhäsionskraft entscheidend, und diese steigt wegen der Zunahme von r wieder an. In dem Moment verliert der Radius des Grundpartikels seine Bedeutung, da her verlaufen die Kurven für alle drei Durchmesser im rechten Bereich identisch. Konkret am Beispiel von Abbildung 66 [60] bedeutet dies, dass bei einem Partikel mit 10 µm Durchesser (R = 5 µm) die Van der Waals Kraft am größten ist bei Oberflächenrauhigkeiten von 0,001 µm und 1 µm, sie beträgt ca. 0,3 µN. Sie ist mit nur 0,007 µN minimal bei Rauhigkeiten von ca. 0,02µm. Bedingt dadurch lassen sich Van der Waals Kräfte kaum zuverlässig unter realen Bedingungen berechnen, sie müssen gemessen werden [97]. Bei unregelmäßig geformten Partikeln, wie es z. B. bei Zement der Fall ist, sind daher die Durchmesser der Oberflächenrauhigkeiten anstelle der Partikeldurchmesser einzusetzen mit den oben ge schilderten Folgen, d.h. Vergrößerung oder Verringerung der Van der Waals Kraft.
O.a. Formeln gelten für ideale Verhältnisse im Vakuum bzw. in einer Gasatmosphäre. Sind die Teilchen in einer Flüssigkeit dispergiert, werden die Van der Waals Kräfte dadurch verändert. Für die Adhäsionskräfte zwischen zwei Teilchen ist dann zusätzlich deren Wechselwirkung zu den Flüssigkeitsmolekülen durch Modifizierung der Hamaker Konstanten zu berücksichtigen.Für den allgemeinen Fall zweier unterschiedlicher Körper (1,2), die durch eine Flüssigkeit als drittes Medium wirken (3), ergibt sich die komplexe Hamaker Konstante A132 zu

Die kombinierten Hamaker-Konstanten wie A12 werden dabei aus dem geometrischen Mittel der Konstanten für die einzelnen Komponenten berechnet [104], d.h.

Die aus den komplexen Hamaker- Konstanten berechnete Anziehungskraft ist umso geringer, je mehr die Konstanten der einzelnen Komponenten (Partikelsubstanzen und Flüs sigkeit) übereinstimmen. Die Hamaker Konstante ist ein materialspezifischer Wert. Sie beträgt nach Haist für Zement 5,24*10 24 J bzw. Nm(≙5,24*10-18µNm) [105] und für Wasser 4,20*10 20 J bzw. Nm (≙ 4,20*10 14µNm), wobei hierfür die Angaben in der Literatur stark streuen [106]. Je größer der Unterschied zwischen den Konstanten ist, desto größer ist die Anziehungskraft.
Wässrige Adsorptionsschichten an Partikeln bewirken eine Zunahme der Van der Waals Kräfte, weil die adsorptiv gebundenen Wasserschichten auf Grund ihrer hohen Spannun gen als zum Partikel gehörend betrachtet werden können, wodurch die Distanz zwischen zwei Partikeln reduziert wird.Die Van der Waals Kräfte wachsen daher an, da sie umso größer werden,je geringer der interpartikuläre Abstand ist [85]. Auch wird der Einfluss der Oberflächenrauhigkeiten durch Adsorptionsschichten verringert werden, da sie so wirken, als wenn die mittleren Rauhigkeitserhebungen verringert werden.
Damit kann die Van der Waals Kraft für den Beispielfall, wie er bereits bei Kap. 2.4.2.1betrachtet wurde, wie folgt berechnet werden (Kontakt von zwei Kugelpartikeln gleichen Materiales, Zement, mit den Durchmessern 1 µm (=D2) und 10 µm (=D1) und einer Wasser filmdicke von 0,03 µm sowie einem Partikelabstand in Höhe der Filmdicke):

Bei einer Distanz von 0,03 µm beträgt damit das Verhältnis der Van der Waals Kraft zur Gewichtskraft FP2 des kleineren Partikels
FvdW,ZWZ/FP2 = 3,53*10-12/1,59*10-11 =0,222
Wenn jedoch davon ausgegangen wird, dass lediglich der minimale Kontaktabstand von 0,4 nm (≙ 0,0004 µm) zwischen den Partikeln vorliegt, dann wächst die Van der Waals Kraft an auf FvdW,ZWZ= 1,99*10-08 N, und damit beträgt das Verhältnis FvdW,ZWZ/FP2 = 1,99*10-08/1,59*10-11 =1.252.
Dieser Vergleich der beiden Abstände verdeutlicht, dass die Van der Waals Kräfte sehr stark abhängig sind von dem Abstand der Oberflächen und mit zunehmender Entfernung sehr rasch abnehmen.